これまでわれわれはコミュニティを作り,それを活用することで生活の質を上げ,今の生活を手に入れたわけだが,2020年に始まったCOVID-19の流行はそれを切り裂くこととなった。すなわち,人と人との接触を避け,ウイルス伝播が起きないようにするという生活を余儀なくされた。
しかしながら,人と人との接触が必要不可欠である医療を継続するにはどのようにするのがよいのか,誰も答えを持っていなかった。そんななか,2020年4月2日に日本不整脈心電学会から「新型コロナウイルス感染拡大に伴う植込み型デバイス診療に関するお願い」1)という文章が発出された。そこで呼びかけられたのは,
- 1.不要不急のデバイス手術や外来フォローを回避すること
- 2.遠隔モニタリングによる長期フォローアップを行うこと
もともとCOVID-19の感染拡大以前から外来でのデバイス管理は半年~1年に1回程度の頻度であったが,この受診間隔を延ばすことが安全かどうかの判断を確実にできる医師はいない。しかしながら,心臓植込み型電気デバイス(cardiac implantable electrical devices:CIEDs)の診療においては遠隔モニタリングシステムが確立しており,その使用が推奨されていた2)。そして,COVID-19感染拡大のタイミングで,日本から,遠隔モニタリングシステム活用による受診期間延長の安全性を定期的な対面診療との比較において検討したAT-Home Study 3) (図1)試験の結果が発表された。この試験は,6カ月ごとの対面診療によるFollowと遠隔モニタリングにより受診間隔を2年に延長してFollowを行った場合の安全性を比較したもので,両者に差は認められないというデータが報告された(一次評価項目の発生率:遠隔モニタリング群10.9% vs. 対面診療群11.8%)。
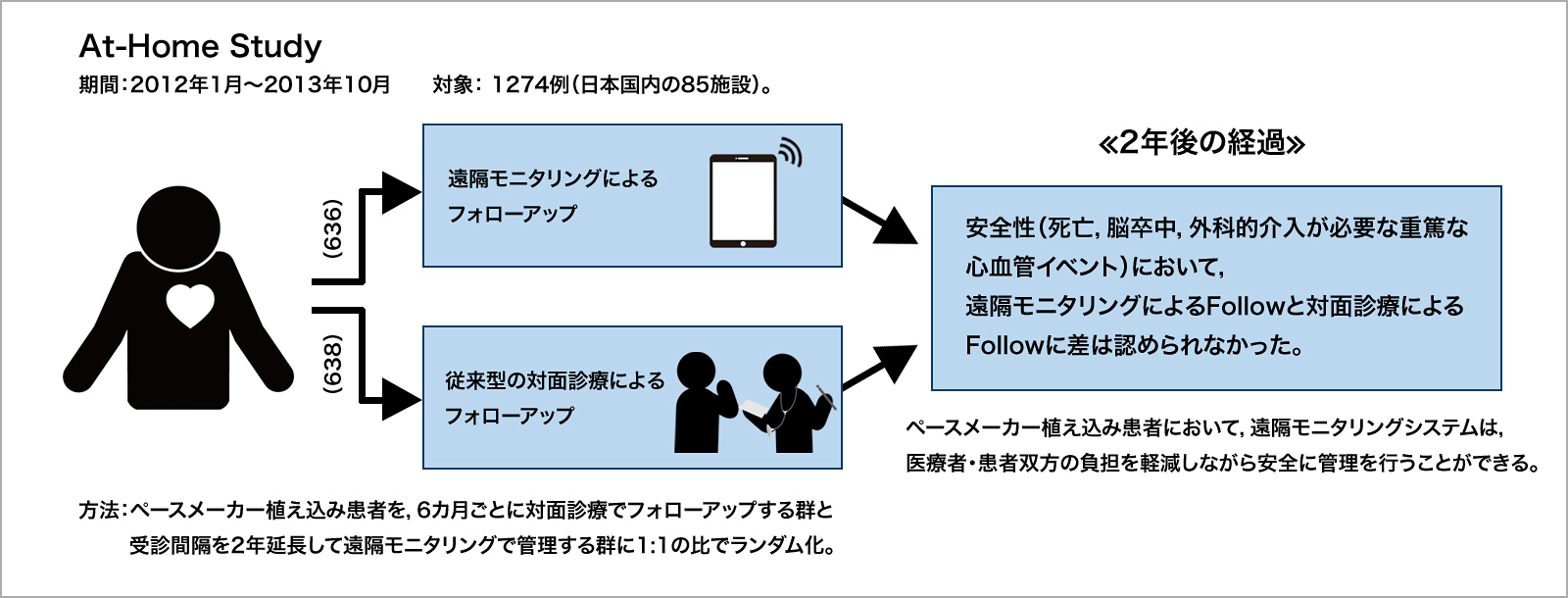
一次評価項目は,死亡・脳卒中・外科的介入が必要な重篤な心血管イベント。RFU(remote follow-up group)とCFU(conventional follow-up group)で一次評価項目に差がないことが示された。
遠隔モニタリングシステムを利用することにより得られる情報はメーカーによって若干の差はあるが,どのメーカーのものでも,基本データである電池残量,リードの状態について知ることは可能で,この電池やリードデータの異常はアラートとしてわれわれ医療者に通知が来るようになっている。これを利用すれば,もし何かのトラブルがデバイスに生じた場合にも医療者側が知ることができるため,当院でもAT-Home Studyの報告のとおり,受信間隔の延長が安全に行えると考えた。当院はほとんどの患者においてすでに遠隔モニタリングシステムを導入して管理を行っていたため,COVID-19感染拡大下においてもこれを活用することは比較的容易であった。
当時,当院では「ペースメーカー外来の予約変更について」*という文章を病院ホームページに掲載し,感染防止の観点から延期を希望する場合にはその相談に応じることとした。すべての患者で最終チェック時の電池残量などを参考に受診期間の延長を可能としたが,すでに遠隔モニタリングが導入されている場合にはより長い受診間隔を許容した。実際に,当院ホームページ掲載後には受診間隔延長希望の連絡が入り,相談の上で受診予約を先延ばしした患者も多数存在した。
(https://yokohamah.johas.go.jp/department/news/20200403_2.html)。
ますます多種多様化する遠隔モニタリングシステムのデータ
最近では,電気的データ以外にも遠隔モニタリングで見られるデータは多種多様になっており,心房細動(A-fib)の発生頻度や活動性,睡眠時無呼吸の指標や心不全に関するデータまで見られるものも出てきた。
実際のデータを提示してみる(図2~4)。各社ともに遠隔モニタリングのページで患者を特定して選択すると最初にこれらのパラメータが見られるようになっている。
図2はMedtronic社のものであり,不整脈イベントの有無などが確認できる。また,胸郭インピーダンスの測定により心不全兆候を察知しようというOptiVolという指標もある。この指標はアルゴリズムが改善されており,心不全管理において期待がされている4)。
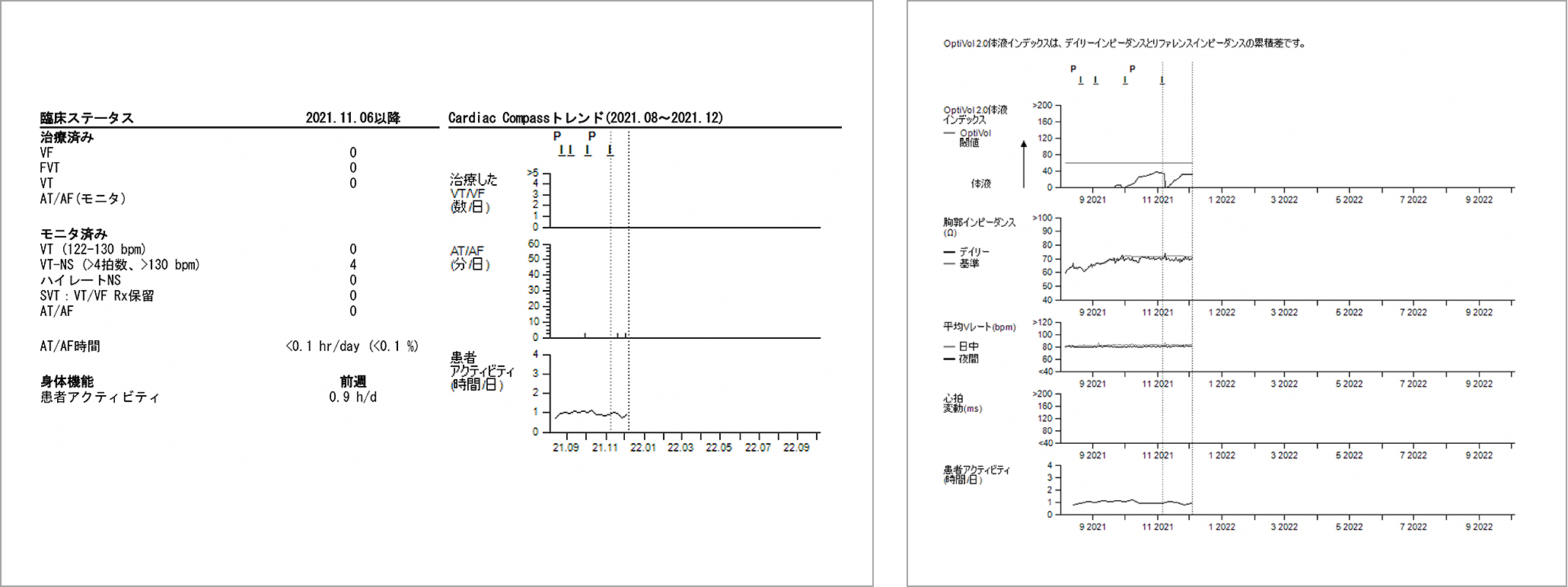
図3はBoston Scientific社の特徴であるHeartLogicインデックスを示している。この指標は胸郭インピーダンスのほか,心音やその他の指標も加わり,総合的に心不全の状態の層別化ができるスコアリングシステムであり,有用性の報告もされている5)。ここで示したのはHeartLogicインデックスが20と上昇しているため,電話などでの介入を行っている最中の症例である。実際の受診をしていなくても心不全治療への介入ができることは遠隔モニタリングの特徴であろう。
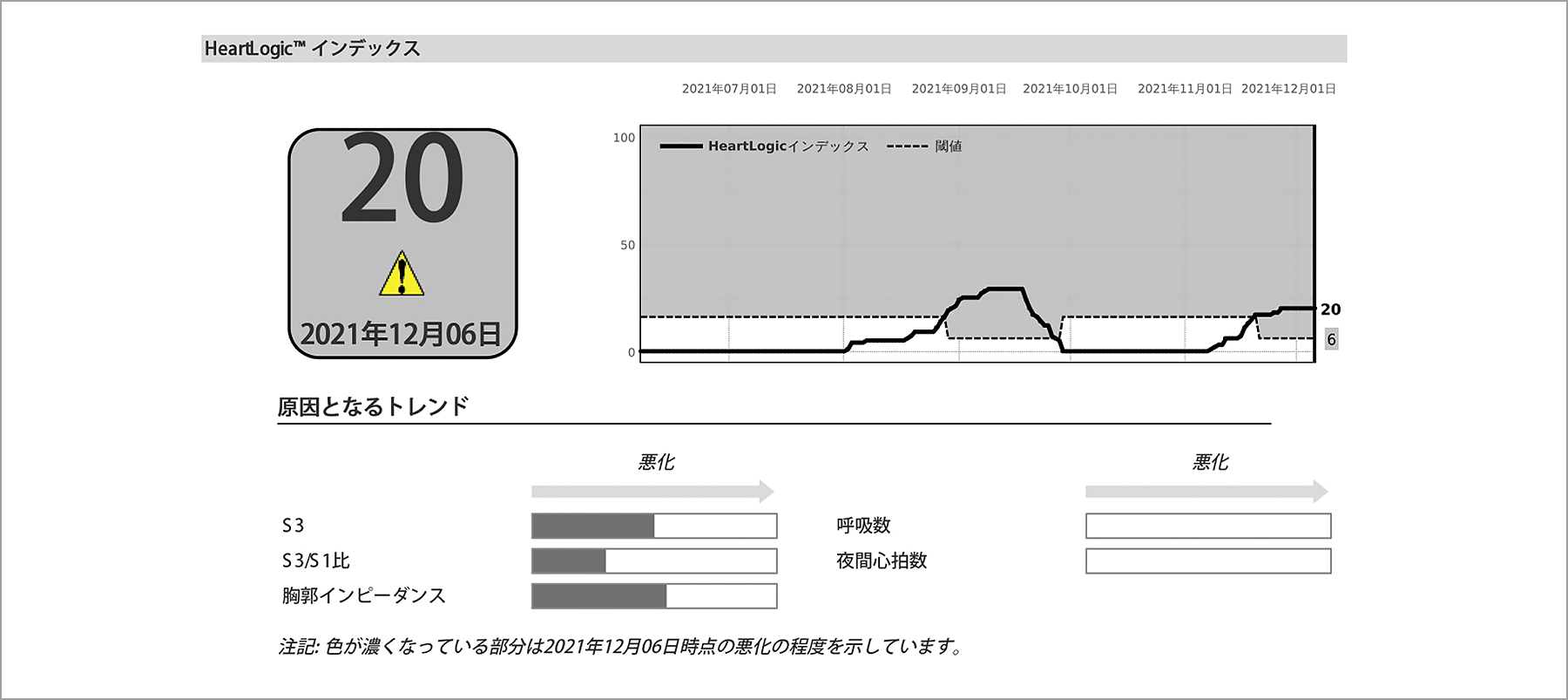
インデックスが上昇すると心不全が増悪していることを示す。本症例では電話で介入を行っているが,入院はせずに治療継続中である。
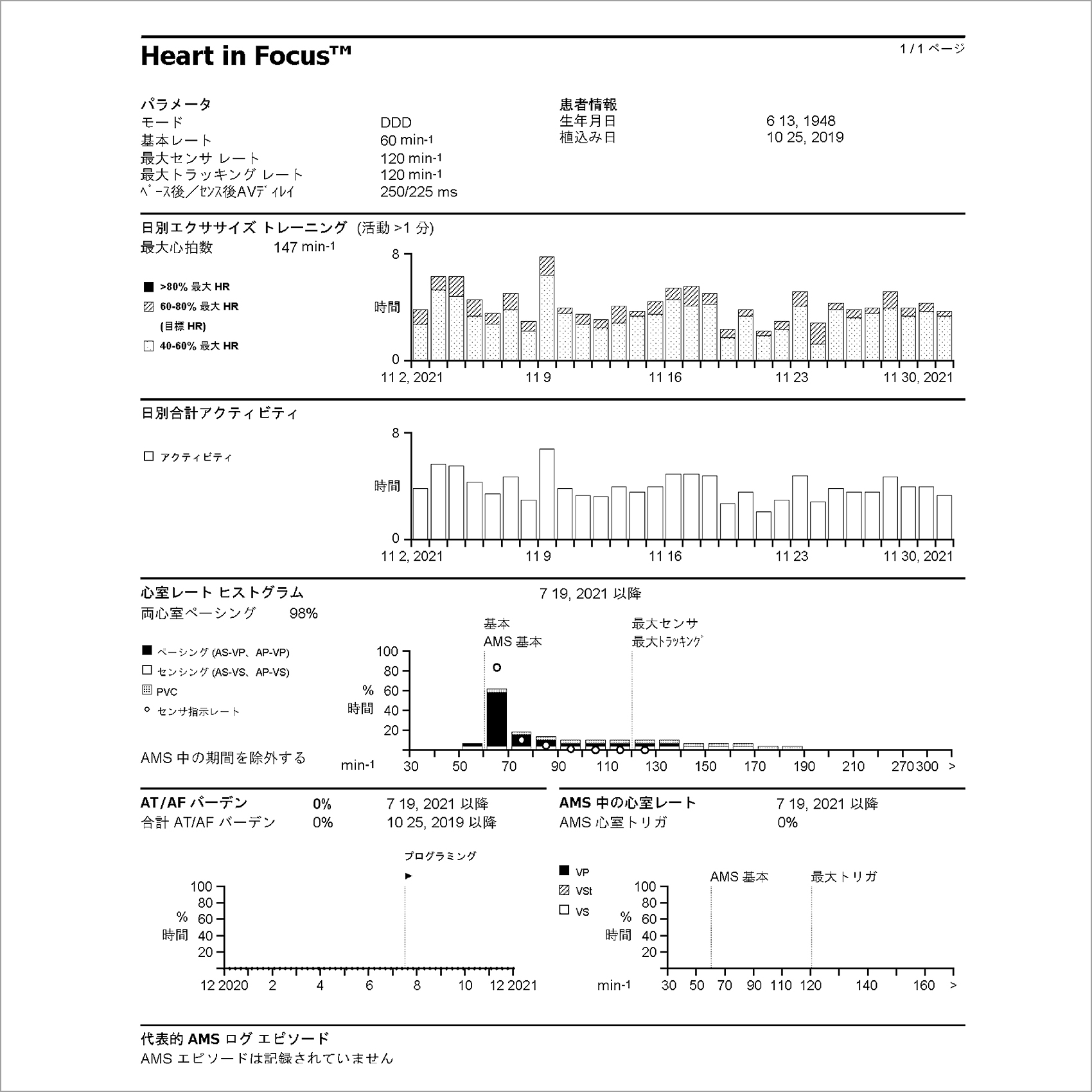
図4はAbbott社のものであるが,ここでも心房細動(A-fib)などの不整脈の発症頻度や活動性心拍変動等のデータが見られるようになっている。
不整脈イベントや活動性などを一覧で見ることができる。
遠隔モニタリングでの実際の症例
「AT/AFバーデンが設定値(> 5%/日)を超過」というアラートメールが届いたため確認すると,図5のように今まで0%だったバーデンが突然上がっていた。数日後に確認したところ,心房細動(A-fib)は持続していたため(図6)電話で状態を確認すると,動悸症状と息切れがあるとのことだったので,ただちに受診を勧め,来院してもらった。
薬物療法を開始し,まずレートコントロールを行ったところ,図7に示したとおり心室レートは徐々に安定し,症状は改善した。自覚症状がよくなったためしばらく薬物療法で経過を見ていたが,心房細動(A-fib)は1カ月以上持続していたため,アブレーションを考えようと思った矢先に心房細動(A-fib)は停止した。自覚症状も劇的に改善して再発もないため(図8),薬物療法を継続して現在も経過を見ている。
本症例では,遠隔モニタリングで発見された心房細動(A-fib)への早期介入によって心不全増悪が回避できた。遠隔モニタリングによる発見がなければ心不全増悪による入院をしていたかもしれず,このようにデータを有効活用することによって受診間隔を安全に行える可能性は格段に向上しているといえるだろう。
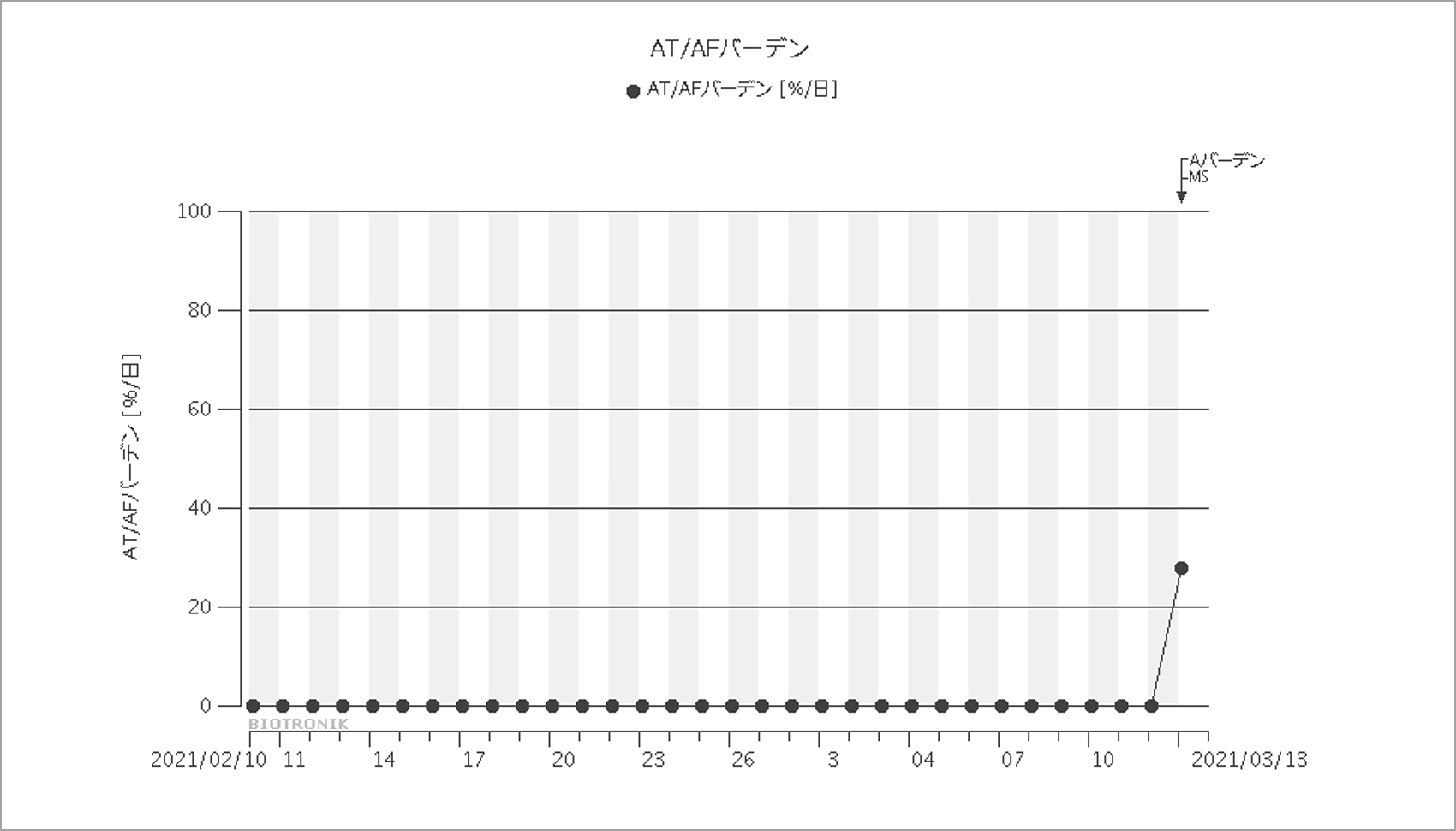
0%であったAF burdenが急上昇を認めた。
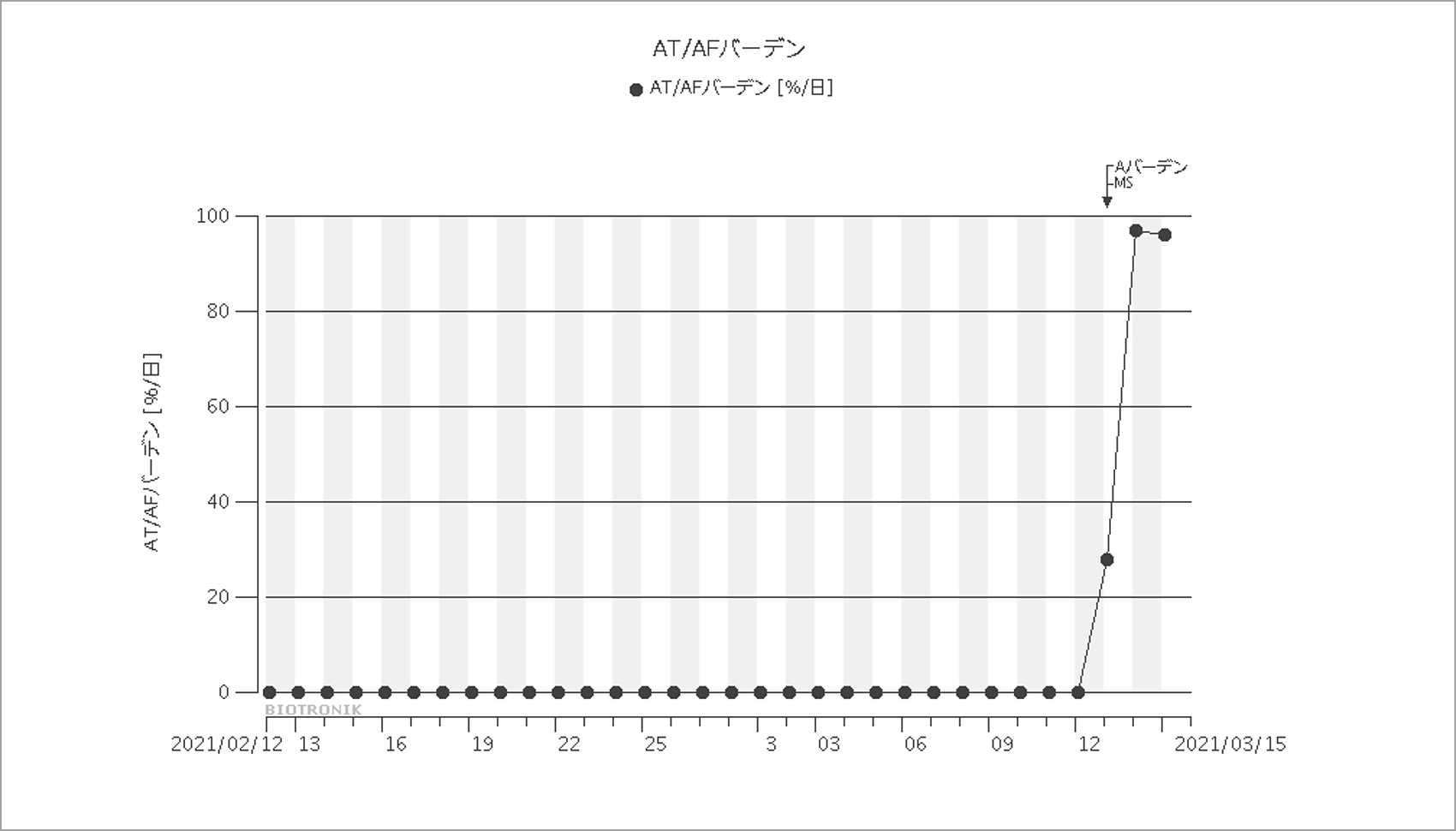
翌日もA-fib Burdenが高い状態が続いていることがわかる。
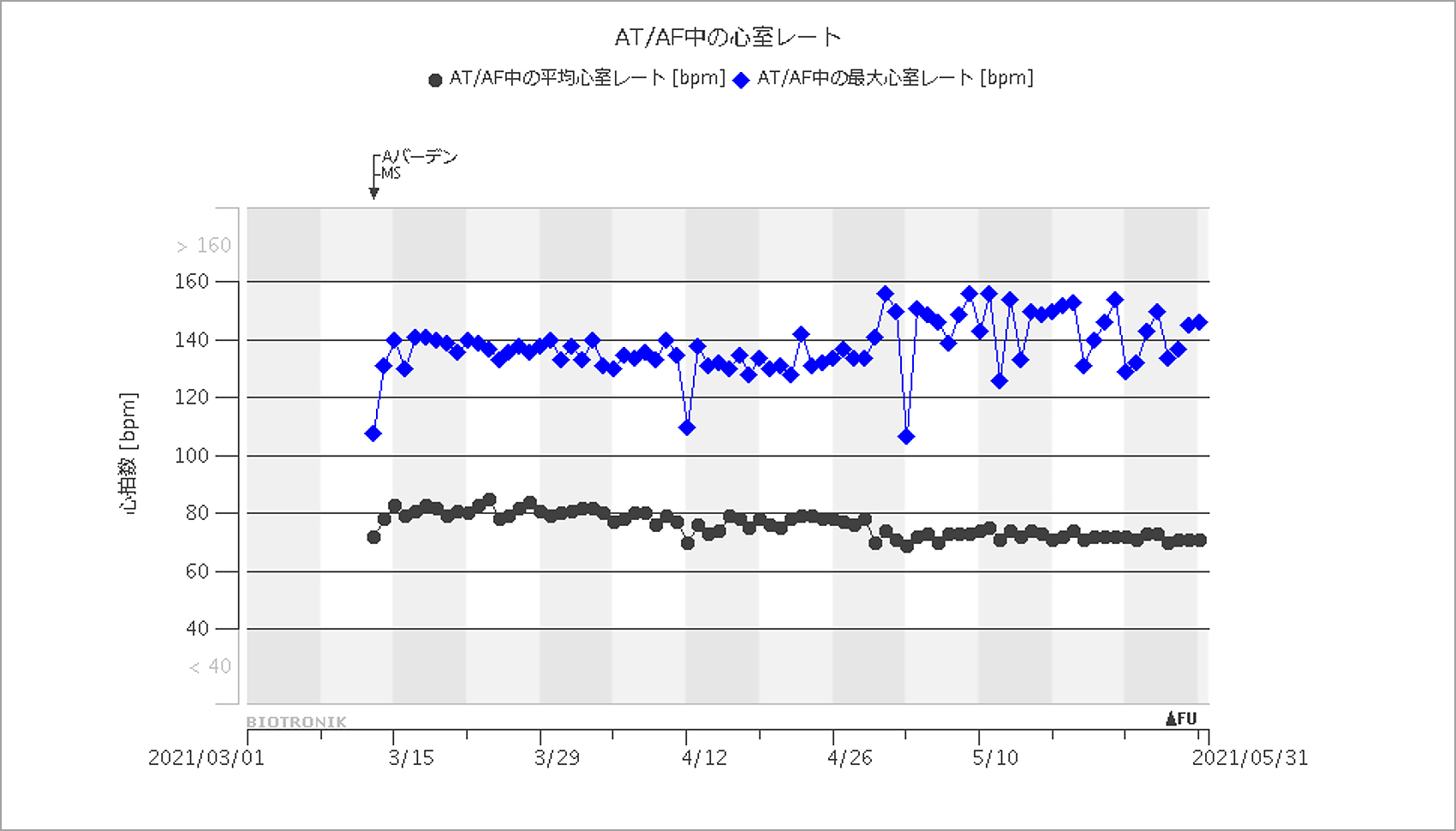
下の黒い線が心室の平均HR。薬剤療法の効果が表れ,徐々に低下していることが見てとれる。
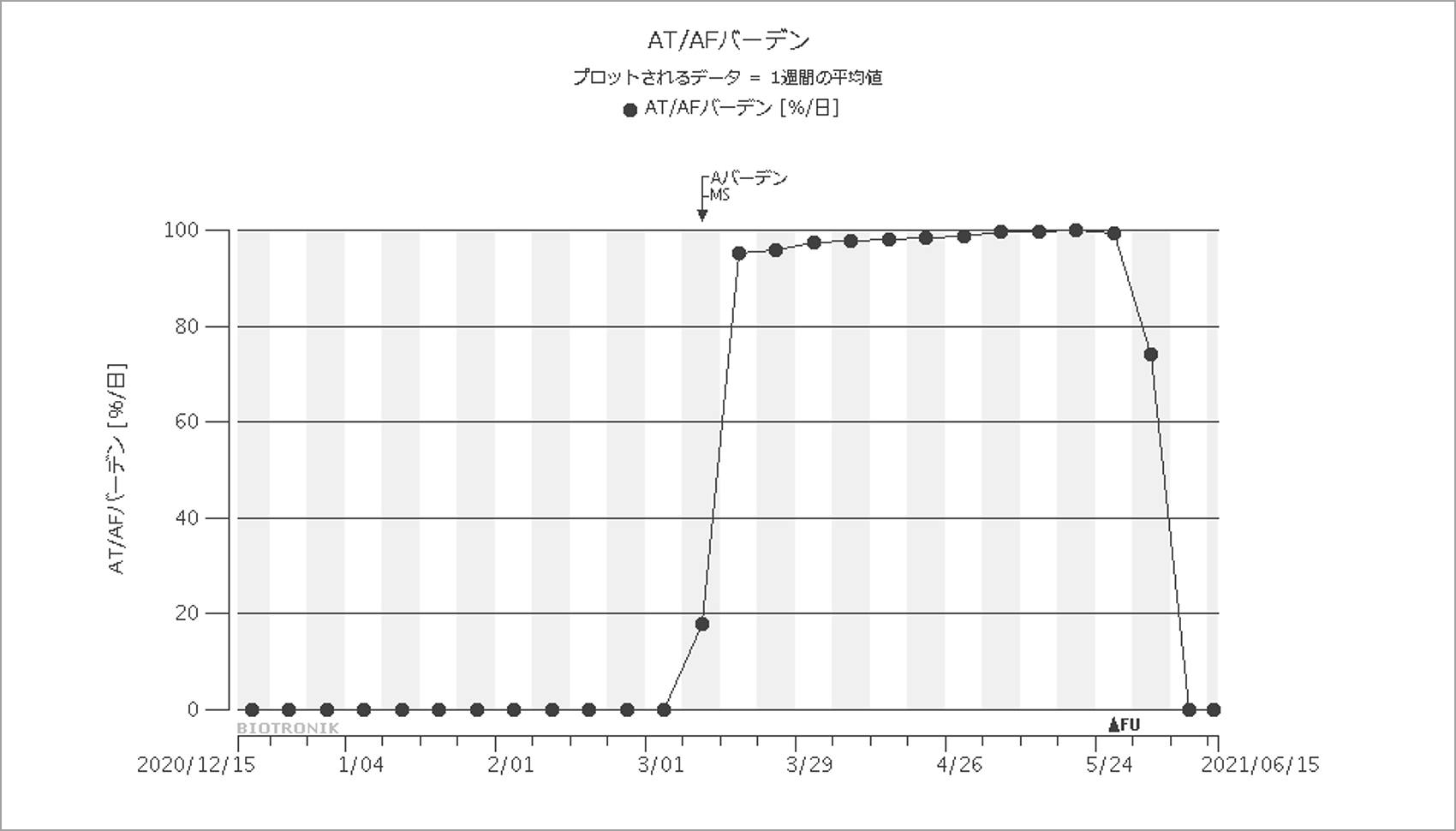
A-fibが停止したことがわかる。
植込み型心電図記録計(Medtronic社製 Reveal LINQ)を植え込んだ症例】
心電図記録計の植え込みを行った2日後に心停止エピソードのアラートメールが届いたため確認すると,図9に示すエピソードが見られた。失神の再発リスクが高いと思われたため自宅に電話連絡してみると,今までの失神と同様の症状を感じたが,受診を迷っていたとのことであった。すぐに来院するよう指示し,そのまま入院,永久ペースメーカーの植え込みを行った。もちろんその後,失神の再発は消失した。
本症例では,患者は症状があったものの受診を迷っていた様子で,遠隔モニタリングによる管理をしていなかったら徐脈への治療介入が遅れ,失神を再発していたかもしれない。
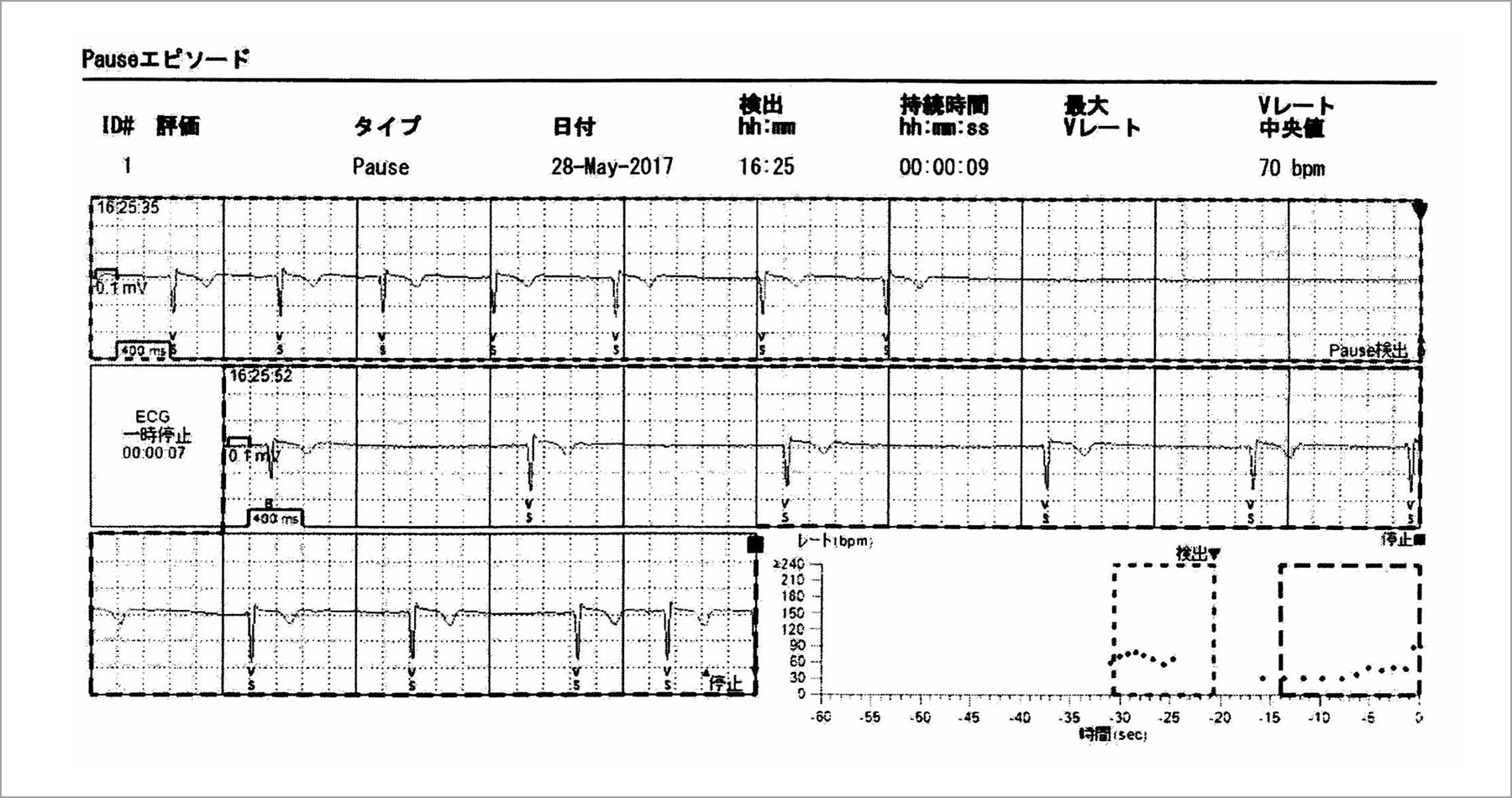
繰り返す失神の精査目的に植込み型心電図記録計(Medtronic Reveal LINQ)の植え込みを行った症例。植え込み2日後に心停止エピソードのアラートメールがあり,確認するとこの心電図のような洞停止エピソードが見つかった。
これら2つの症例で見たとおり,患者の状態変化を早期に発見できるのが遠隔モニタリングの最大の利点である。これを活用することにより,安全性を下げることなく受診間隔を延長するというCOVID-19対策が可能となる。もちろん患者状態の変化だけでなく,デバイスの異常の早期発見に関しても遠隔モニタリングが寄与することに関しては,すでに本特別企画第3回(慶應義塾大学 医学部 循環器内科 三山寛司 先生 / 高月誠司 先生の投稿)でも述べられていたとおり,当院でもリード断線を遠隔モニタリングによって早く察知し,リスクを回避できた症例がある。
しかしながら,現在の診療システムにおいて,受診間隔を延長させることによる病院側のデメリットも存在する。それはコストの問題である。
CIEDsの患者は外来受診時に管理料を算定する。遠隔モニタリング実施患者においては「遠隔モニタリングによる療養上必要な指導を行った場合に遠隔モニタリング加算が算定できる」とされているが,この算定は11カ月分が限度であるとされている。つまり,遠隔モニタリングの加算は受診時に算定する必要があることから,1年以上受診間隔が空いてしまうと,遠隔モニタリングを行って管理を行っているにもかかわらず管理料が算定できない月が存在することとなり,病院としては管理を行うための人件費がかかりながらもコストが算定できないという状態が発生する。今回はCOVID-19パンデミックという特殊状況下であり,やむを得ない状況であったかもしれないが,今後この問題は解決すべき問題であろうと思われる。
またもう一つ,受診間隔が延長することのデメリットとしては,設定が適切であるかどうかの判断をする機会が減ってしまうことである。遠隔モニタリングで見られるものは基本的にはデバイスの電気的データや実際に起こった不整脈のイベントなどであり,症状までは見えない。
私は過去にICDの設定をバックアップであった50 bpmの設定から70 bpm+rate responseの設定に変更しただけで心不全症状が劇的に改善し,BNPも277 pg/mLから32 pg/mLに改善した症例を経験したことがあり,この経験によりデバイス診療における設定の重要さを痛感させられた。このような症状に応じた設定変更などは,やはり実際に対面で話をしない限りは実施できないので,患者に応じて柔軟に受診間隔を検討することが必要であろう。
COVID-19の感染状況はいまだ終わりが見えない。そのため,感染リスクを抑えつつ最大限のCIEDs管理ができる遠隔モニタリングは強力なツールであり,現在のCOVID-19パンデミックの状況下において活用すべきであると考えられる。
参考文献
- 日本不整脈心電学会ホームページより(2022年2月閲覧).
http://new.jhrs.or.jp/pdf/others/info20200402-01.pdf- Slotwiner D, et al. HRS Expert Consensus Statement on remote interrogation and monitoring for cardiovascular implantable electronic devices. Heart Rhythm. 2015; 12: e69-100. PMID: 25981148
- Watanabe E, et al. Remote Management of Pacemaker Patients With Biennial In-Clinic Evaluation: Continuous Home Monitoring in the Japanese At-Home Study: A Randomized Clinical Trial. Circ Arrhythm Electrophysiol. 2020; 13: e007734. PMID: 32342703
- Wintrich J, et al. Remote Monitoring With Appropriate Reaction to Alerts Was Associated With Improved Outcomes in Chronic Heart Failure: Results From the OptiLink HF Study. Circ Arrhythm Electrophysiol. 2021; 14: e008693. PMID: 33301362
- Capucci A, et al. Preliminary experience with the multisensor HeartLogic algorithm for heart failure monitoring: a retrospective case series report. ESC Heart Fail. 2019; 6: 308-318. PMID: 30632306

