新型コロナウイルス感染症(COVID-19)は,初めて患者が認定されてから1年以上が経った今も,世界各地で拡大し続けている。
日本でも2021年2月にワクチン接種が始まったが,感染拡大の抑制となるか,いまだ先行きは不透明である。新型コロナウイルスの排出は,発症の2~3日前より始まり,発症直後に感染力がもっとも強いと報告されている1)。
そのため,患者が無症候であっても感染リスクがあることから,医療機関では可能なかぎり対面診療を避けたほうがよく,対面で実施が必要な検査や治療に関しても,COVID-19感染対策を十分に行ったうえで実施する必要があると思われる。
心臓植え込みデバイスの遠隔モニタリングの実際
COVID-19の感染拡大を受け,米国不整脈心電学会は,「患者と直接対面することなく,心臓植え込みデバイス(cardiac implantable electronic devices: CIEDs)をチェックすることのできる遠隔モニタリングを活用すべきである」との提言を発表している2)。
CIEDsの遠隔モニタリングシステムは,もともと効率よくデバイスと患者を管理するために開発されたものである。デバイスの情報を患者の自宅に設置した中継機器から専用サーバーに送り,それを病院にいる医療従事者ら(医師,看護師,臨床工学技士など)が確認できる仕組みになっており,患者に生じた異常やイベントの早期発見と対応が可能になるというメリットがある。
COVID-19感染が拡大する現下の状況では,人と人との“密”を回避しながら,デバイス植え込み患者の異常やイベントを早期に検出できる,患者,医療機関双方に有用なツールだと思われる。
心臓デバイスの遠隔モニタリングは,これまでさまざまな臨床試験によって,対面診療とくらべ,安全性で劣ることなく,デバイスの異常や不整脈イベントを早期に発見できることが示されている3,4)。
実際,ICDおよびCRT-D患者におけるランダム化前向き試験であるIN-TIME試験では,患者の生命予後において,遠隔モニタリング群が従来治療群に比し大幅に改善したと報告された5)。
遠隔モニタリングは,イベントの早期発見・対応という患者側のメリットのほか,外来受診回数が減るなど医療従事者の業務軽減にも役立つ一方で3),定期送信を行うとデータの解析,患者への連絡,カルテへの記録などの作業が増えるため,医療機関においてはチーム体制を構築し,チームでのアラート管理が必要となる。そのために,医師,看護師,臨床工学技士らデバイスに携わる多職種による運用体制を築くことが求められる。
当院の例を紹介すると,一定のアラート管理に対するStandard Operating Procedures(SOP)の活用がある。SOPとは業務や作業を進めるための手順を詳細に記した指示書のことであり,ある一定の条件を満たした場合にはメディカルプロフェッショナルから医師への報告は不要とし,アラート管理の効率化に役立てている。実際に当科で使用しているSOPの例を示す(図1)。
当院では,このSOPを用いて円滑な管理を行うよう努めている。
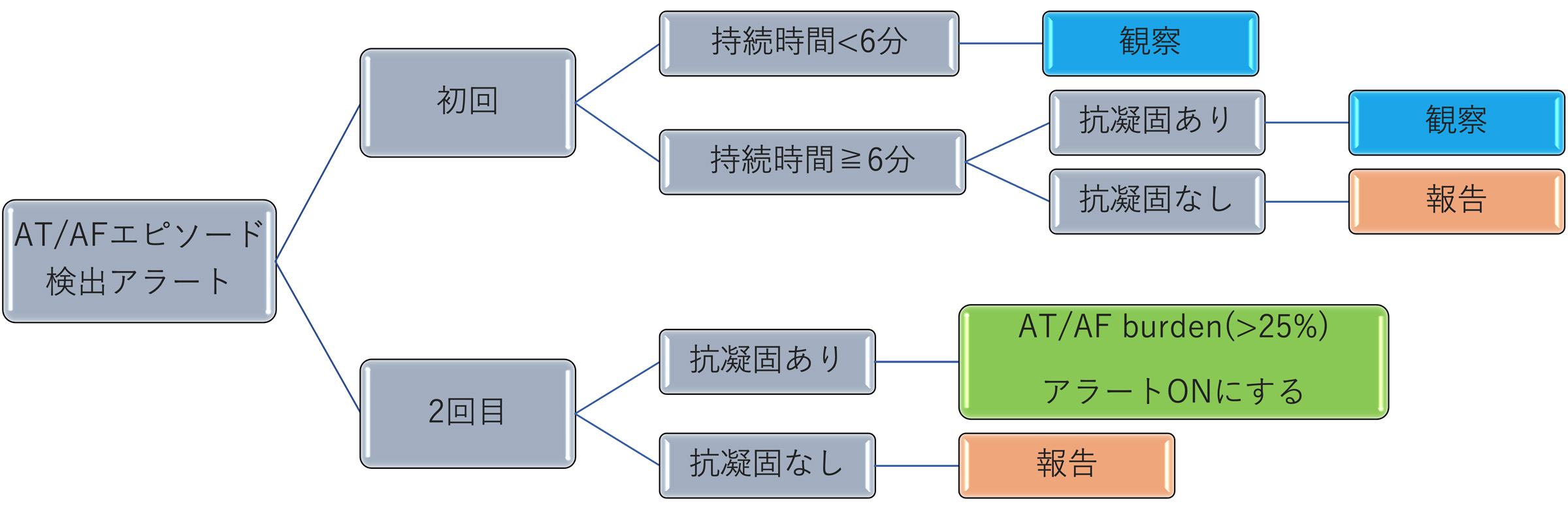
遠隔モニタリングの実際 ―― 浦添総合病院の例
2021年3月1日現在,当院では遠隔モニタリングにより400人以上の患者を管理しているが,次に当院での遠隔モニタリングの運用方法と治療介入等のデータを紹介したい。
対象は,2018年4月1日~2020年3月31日の期間,当院で遠隔モニタリングを使用し,フォローされたCIEDs植え込み患者である。
遠隔モニタリングによるアラート送信を確認した場合,まずSOPを用いて図1の手順で判断を行う。医師への報告が必要と判断されたケースでは,看護師が患者連絡を行い,IN-TIME試験と同様,質問票(図2)を用いて介入の要否を判断する。

遠隔モニタリングアラートが発生した患者に電話連絡する際にこの質問票を使用。
対象期間における総アラート数は8577件,うち患者連絡が必要だったのは154件であった。アラート送信により検出された受診が必要なイベント・異常の内訳は,心室頻拍(42件),上室性頻拍(40件),胸郭インピーダンス異常(27件),ノイズ(14件),その他であった。
介入後の対応としては,心不全入院(11件),3カ月以内のインターベンション[経皮的冠動脈形成術(PCI)7件,アブレーション14件]があり,死亡発見も2件あった。このように当院では,遠隔モニタリングにより早期発見でき,後日治療介入ができた症例を多数認めた。
このような実例からみても,遠隔モニタリングシステムは,対面診療に代わる手段として方法が確立されつつあり,COVID-19流行に際して,可能なかぎり導入することが望まれる。
COVID-19感染予防を考慮した従来の検査,治療の見直し ―― 浦添総合病院での工夫
COVID-19感染症の流行後,日本心エコー図学会からは,「経食道心エコー図は大量のウイルスのエアロゾル化を引き起こす高リスクな検査法である。治療方針を変更する可能性が低い場合や別の画像診断で必要な情報を提供できる場合は,延期,中止する」などの対策を講じるようにとの提言が出されている6)。
以下に,左房内血栓評価とカテーテルアブレーション治療時の気道管理における当院でのエアロゾル化対策を述べる。
工夫1心房内血栓の有無の評価
心房細動に対するカテーテルアブレーション治療の術前には,左房内血栓の有無の評価が必要である。この場合,一般的には,経食道心臓超音波検査を行うが,ウイルスのエアロゾル化を引き起こす可能性がある。
そこで当院では,経食道超音波検査に代わる別の画像診断による評価を検討した。Kawajiらによれば,心臓造影CT検査に腹臥位での撮影を追加することで,左心耳内血栓を否定できた7)と報告されている。
そのため当院では,エアロゾル化のリスクの低い腹臥位心臓造影CT検査を用いて,左心耳内血栓の有無の評価を積極的に行っている。
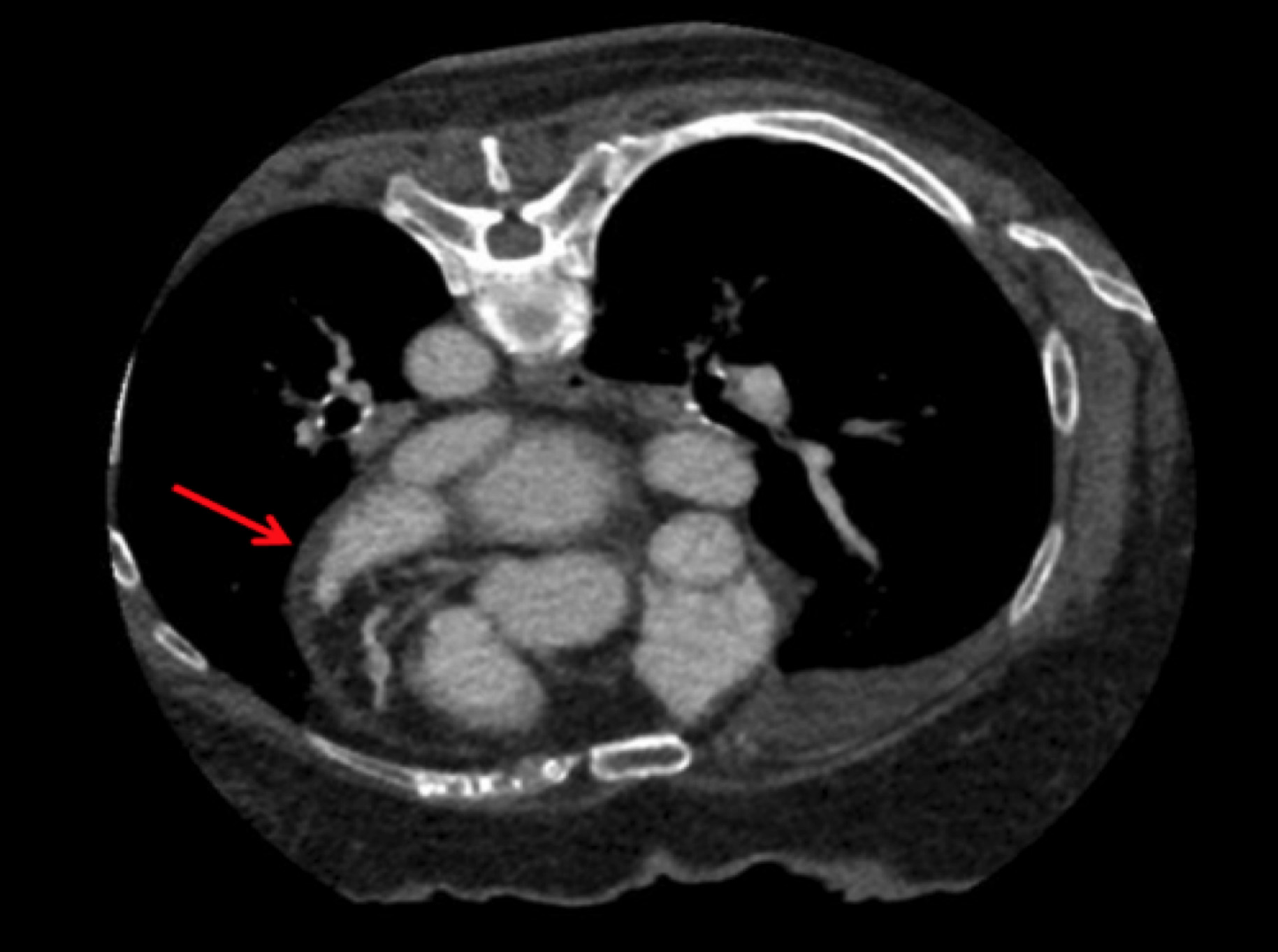
左心耳先端まで均一に造影剤が流入しており,左心耳血栓がないことを確認できる(赤矢印)。
工夫2カテーテルアブレーション時の全身麻酔
カテーテルアブレーション時にはラリンジアルマスク(i-gel®)を使用し,人工呼吸器療法を行っている。全身麻酔が意識下鎮静と比較しカテーテルアブレーションによる心房細動の再発が68%も低かったとの報告があり8),当院でも全身麻酔導入下でのアブレーション治療を行っている。
全身麻酔導入と抜管は,N95マスクと医療防護服を着用して行っている。その際には,医師と介助を行う看護師以外はカテーテル室外へ退出し,最小限の医療従事者で行うようにしている。また,ウイルスのエアロゾル化を抑えるため,高性能エアフィルターであるHEPA(high efficiency particulate air)フィルター付き閉鎖型人工呼吸器を使用している。カテーテル室はHEPAフィルターを設置したクリーンルームであり,術後は換気を行い,リスク軽減を図っている。
COVID-19の流行は,循環器診療においても診療体制に変化をもたらしている。感染対策だけでなく,従来の手技内容や検査方法の見直し,エアロゾル化対策を行い,できるかぎり対面診療を避ける工夫なども必要であると思われる。
参考文献
- Lauer SA, et al. The Incubation Period of Coronavirus Disease 2019 (COVID-19) From Publicly Reported Confirmed Cases: Estimation and Application. Ann Intern Med. 2020; 172: 577-582. PMID: 32150748
- HRS COVID-19 Task Force Update: April 15, 2020 Cardiac Implantable Electronic Device (CIED) Management.
https://www.hrsonline.org/COVID19-Challenges-Solutions/hrs-covid-19-task-force-update-april-15-2020- Crossley GH, et al. The CONNECT(ClinicalEvaluation of Remote Notification to Reduce Time to ClinicalDecision)trial : the value of wireless remote monitoring with auto-matic clinician alerts. J Am Coll Cardiol. 2011; 57: 1181-1189. PMID: 21255955
- Varma N, et al. Efficacy and safety of automatic remote monitoring for implantable cardioverter-defibrillator follow-up : the Lumos-T Safely Reduces Routine Office Device Follow-up(TRUST)trial. Circulation. 2010; 122: 325-332. PMID: 20625110
- Hindricks G, et al. Implant-based multiparameter telemonitoring of patients with heart failure(IN-TIME): a randomised controlled trial. Lancet.2014; 384: 583-590. PMID: 25131977
- 日本心エコー図学会. COVID-19流行期における心エコー図検査に関する提言
http://www.jse.gr.jp/COVID-JSE%20statement_summary.pdf
提言改訂にあたり
http://www.jse.gr.jp/COVID-JSE%20statement3.pdf- Kawaji T, et al. Real-time surveillance of left atrial appendage thrombus during contrast computed tomography imaging for catheter ablation: The Reliability of cOMputed tomography Beyond Ultrasound in THROMBUS detection (THROMBUS) study. J Thromb Thrombolysis. 2019; 47: 42-50. PMID: 30251193
- Di Biase L, et al. General anesthesia reduces the prevalence of pulmonary vein reconnection during repeat ablation when compared with conscious sedation: results from a randomized study. Heart Rhythm. 2011; 8: 368-372. PMID: 21055479

