2019年末に端を発した新型コロナウイルス感染症は, またたく間に全世界に蔓延し, 1年足らずで保健衛生や経済の観点から私たちの生活概念を根底から覆した。
世界的なパンデミックが医療分野における転換点になったことはいうまでもなく, 新生活様式に準じて, 従来の診療体制も抜本的な見直しが求められるに至った。
昨今デジタルトランスフォーメーション (DX)が注目されているが, 患者との直接対面が基本であった医療分野においても例外ではない。情報通信端末を用いたオンライン診療1)や, 最近ではスマートフォンのアプリやスマートウォッチなどを活用した診療への応用も見受けられるようになったが, それでもなお, 一般臨床においてこれら新しい診療形態が占める割合はごく一部であり, いまだに診療の基本は患者対医療者の対面診察であることは否めない。
今回のコロナ禍を契機にこの現状が浮き彫りとなり, 医療の現場における診療スタイルの変革が急務となっている。
われわれが所属している循環器内科の不整脈部門は, 特にペースメーカや植込み型除細動器(ICD)などの心臓植え込みデバイスの分野において遠隔モニタリングのシステムが発展している。
コロナ禍以前より個人同士の直接のコンタクトを避ける, ‟密をつくらない”素地がすでにできあがっており, その下での診療に従事している。そのような背景から, 不整脈治療デバイスの遠隔診療について寄稿させていただいた次第である。
そもそもペースメーカやICDなどの心臓植え込みデバイスは, 植え込み後は心内のモニタリングを24時間365日, 常日頃行っている。外来でのフォローアップはデバイス機能や患者の容態の確認のために肝要だが, フォローの頻度は施設や医療者によって異なり, その間の患者の容態変化や不整脈イベント, デバイスのパラメータの異常に対しての認知や対応も不均一なものとなってしまう原因となる。このような中で, 遠隔モニタリングシステムは外来診察での直接の機器のフォローアップの代替手段として現在主流となってきている。
従来は外来にてプログラマーを患者のデバイスに直接当てて, 毎回デバイスのインテロゲーション (不整脈等のイベントデータや電池容量やリードの状態等のデバイスのパラメータの確認作業)を行っていたが, 遠隔モニタリングでは, 機械本体によって日々アップデートされるこれらの情報が, 患者の自宅に設置した送信機からワイヤレスかつ自動で送信され, 医療機関側とインターネットを介して情報共有がなされる (図1)。そのため, 日々連続した情報の受信によって, 患者が来院受診しなくても各種イベント (不整脈の検出, ショック作動, 不適切作動, リードの断線, 電池残量の枯渇, その他想定外の事象)に対して迅速な対応を取ることができ, 患者の受診頻度も減らすことができる。

遠隔で送信されてくるデバイスデータのサマリー画面。患者情報や植え込み日などのほか, 不整脈などの生体データや電池やリードなどのデバイスのパラメータを一覧にして確認・管理ができる。
遠隔モニタリングシステムではICDや心不全患者に対する心臓再同期療法 (CRT)導入後において有効性の報告が多く, 不整脈や心不全増悪に対する常時モニタリングによって, 臨時受診の削減や患者の生命予後の改善に寄与することが報告されてきた2-5)(図2)。こうしたメリットから, 現在では, 日本不整脈心電学会からのステートメントにおいても心臓植え込みデバイスの標準的な管理手段としての遠隔モニタリング導入が推奨されており6), 米国不整脈学会(HRS)からの勧告においてもデバイス植え込み患者における遠隔モニタリングの導入は推奨クラスIに位置づけられている7)。さらにはこのたびのCOVID-19の感染拡大も追い風となり, 感染リスク減少のため対面診療を減らし, 密を避けた診療が可能な遠隔モニタリングの新規導入が改めて勧告されている8,9)。
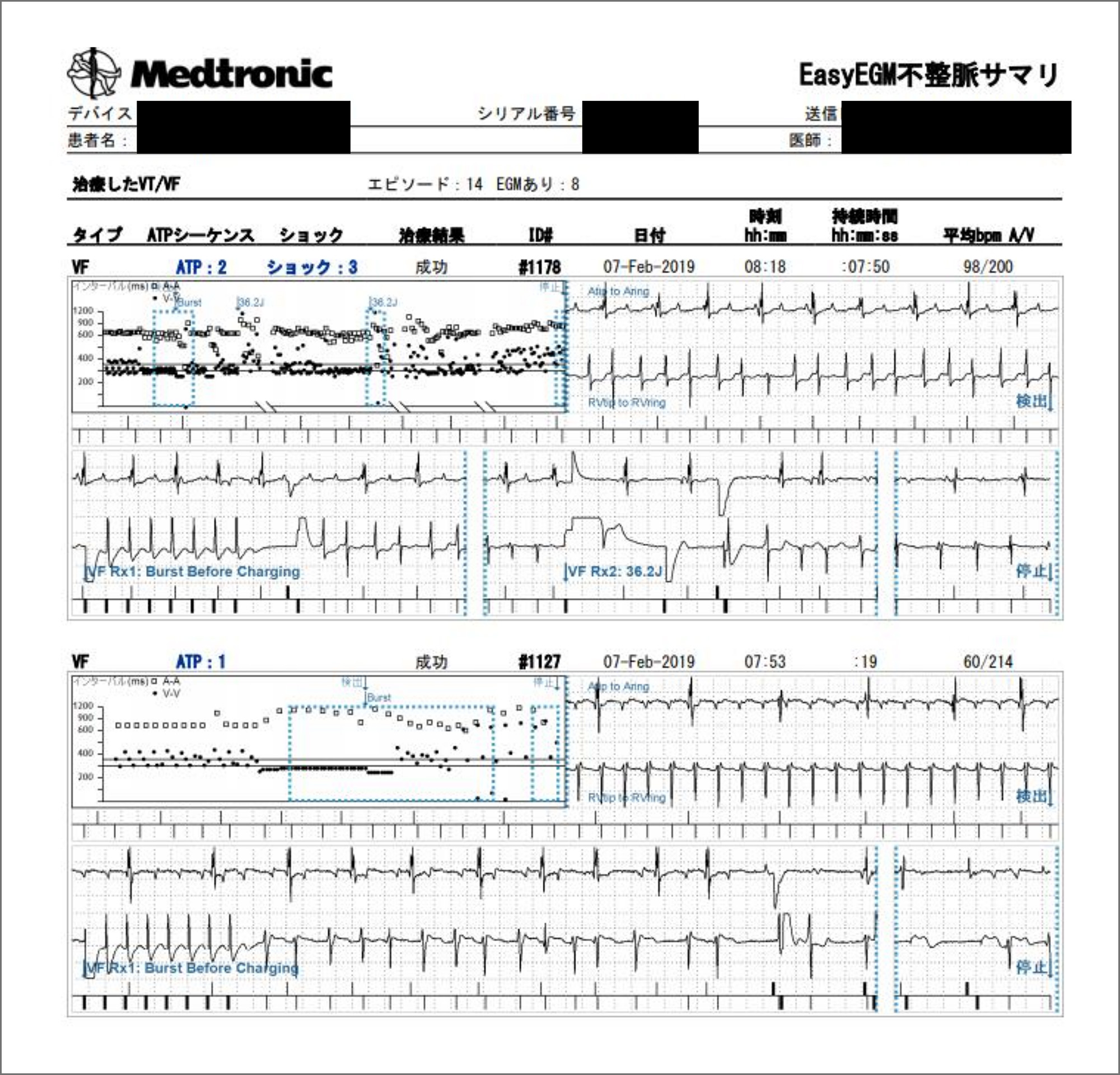
拡張型心筋症に対して除細動機能付き心臓再同期療法 (CRT-D)を導入した患者。抗頻拍ペーシング (ATP)とショック作動を伴う心室頻拍発作を生じ, 遠隔アラートとして受信した。図のように心内心電図の確認や作動内容, 治療状況も確認できる。本症例では, 早急に患者に連絡し, 同日受診してもらったうえで, 服薬コントロールとデバイスの設定調整を行った。
現在, 当院においては, 外来フォローアップ患者約750名のうち, およそ75%にあたる570名程度が遠隔モニタリングを導入しているが, このうち新規植え込み患者においては, 希望をしない患者 (主にご高齢で独居の方)を除いたおよそ9割近くで導入されている。特にコロナ禍において, 遠隔モニタリング導入の傾向はより顕著になってきており, 外来診察の際や電池の交換手術を契機に今まで導入していなかった患者に対して新規に導入を図ることも積極的に行っている。
遠隔モニタリングを用いたデバイス管理の運用体制の構築には, 多職種間での連携が必須である。医師, 臨床工学技士をはじめ, 看護師や事務ともあらかじめ管理方法についての取り決めを行うことが必要である。ペースメーカでは刺激閾値やリードインピーダンスの極端な変化に, またICDでは頻脈治療エピソード時の医療者にメールで送られてくるアラート通知への対応の手順について, 事前に確認しておくことが重要である。
当院での具体例を挙げると, アラートがあった際に, 送信されてきた情報を医師または臨床工学技士が確認し, 医師から患者に直接連絡を取り, 病状を確認したうえで, 対面診療のために来院を指示したり, 急迫している場合には近医への受診指示を検討している (図3)。休日や夜間帯のアラートの場合には, 宿直医と連携を取りながら患者へのコンタクトを図り, 上記に準じた対応を行っている。
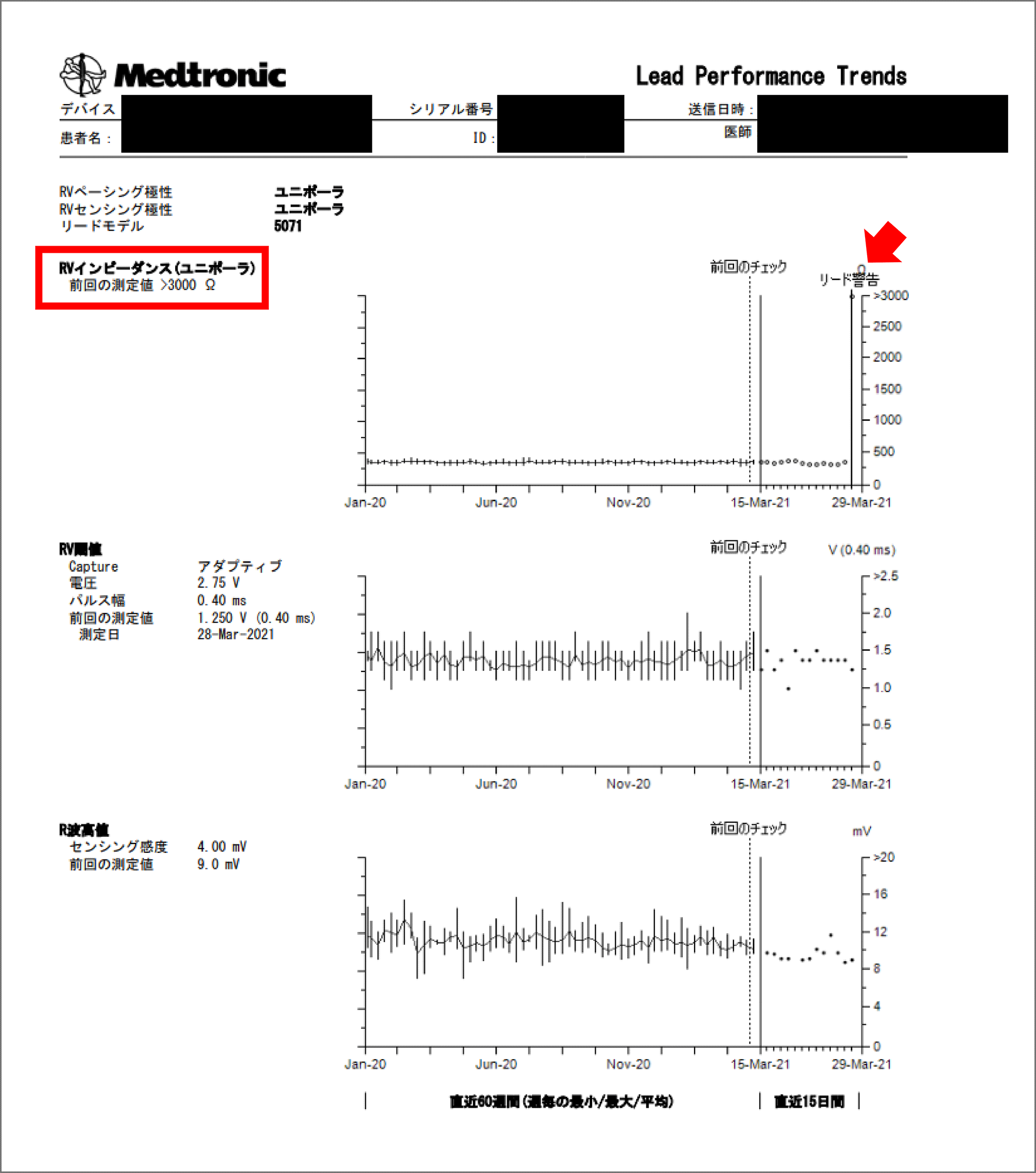
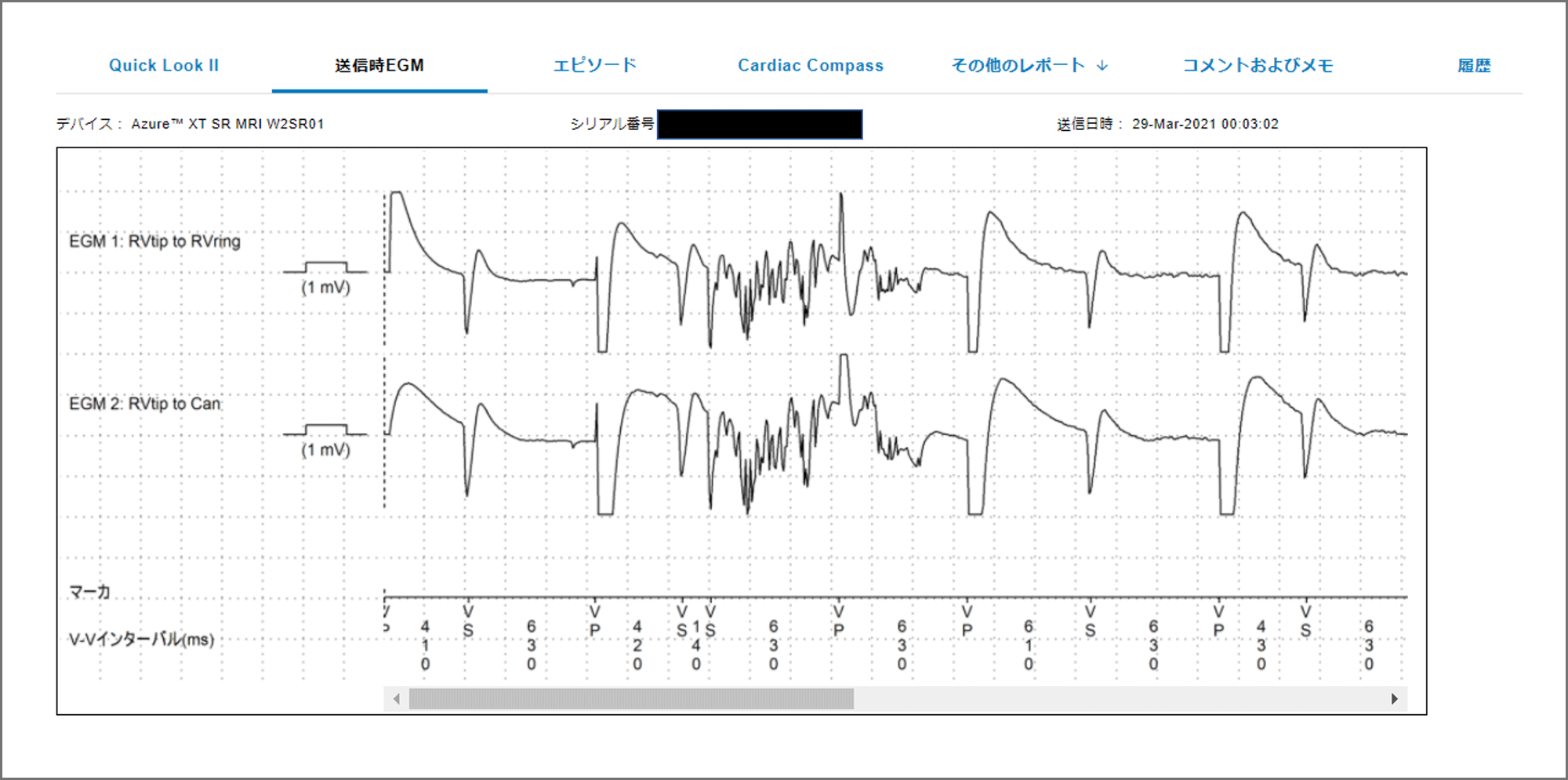
完全房室ブロックに対してペースメーカ留置後の患者。リード抵抗の急激な上昇があり, リード断線疑いでアラート送信となった。リードの各種パラメータを時系列のトレンドで見ると, 赤枠と矢印で図示したようにリード抵抗が振り切れるように急上昇しているのがわかる。心内心電図を確認するとリード断線を疑うノイズも確認された。ペーシング依存患者であったため, 即日入院とし, 後日新規リードの追加を行った。
遠隔モニタリングシステムを導入し, 小康状態で経過している症例においても, 当院では通常1年に1回以上の頻度で対面診療を行っている。遠隔モニタリングを導入した症例では, 診察頻度を削減できるだけでなく, 非導入例と比較してみた場合, 診察前にデバイスから送信されてくる解析データをあらかじめ確認できるため, プログラマーと植え込み機器との交信, インテロゲートが不要となる。また, 患者とのソーシャルディスタンスを保ち, 直接の接触や診察時間を最小限に減らせるというメリットも生まれる。慣習的な対面診察が少ないぶん, 導入時点で患者の状態については十分なアセスメントを行い, 平静時あるいはイベント発生時の患者の安全を確保することが最重要の課題となる。
一方で, 日々連続した情報を受信できることで, むしろ患者の容態やデバイスの状態の綿密な管理が可能となるだけでなく, 上述のように患者との時間的・物理的接触の削減と効率的診療が両立できるようになる。また, 患者にも外来間隔の延長や診察待機時間の短縮といったメリットがもたらされ, 満足度の改善に貢献している。
今回, われわれが平時実践している遠隔診療体制について共有させていただいたわけだが, 密や接触を避けるべく新様式への転換が迫られる一般診療の現場において, 何かしらの形で皆さまの日常診療の一助となれば幸いである。
参考文献
- 厚生労働省. オンライン診療の適切な実施に関する指針 (2018年)
https://www.mhlw.go.jp/content/000534254.pdf- Varma N, et al. Efficacy and safety of automatic remote monitoring for implantable cardioverter-defibrillator follow-up: the Lumos-T Safely Reduces Routine Office Device Follow-up (TRUST) trial. Circulation. 2010; 122: 325-332. PMID: 20625110
- Guédon-Moreau L, et al. A randomized study of remote follow-up of implantable cardioverter defibrillators: safety and efficacy report of the ECOST trial. Eur Heart J. 2013; 34: 605-614. PMID: 23242192
- Hindricks G, et al. Implant-based multiparameter telemonitoring of patients with heart failure (IN-TIME): a randomised controlled trial. Lancet. 2014; 384: 583-590. PMID: 25131977
- Parthiban N, et al. Remote Monitoring of Implantable Cardioverter-Defibrillators: A Systematic Review and Meta-Analysis of Clinical Outcomes. J Am Coll Cardiol. 2015; 65: 2591-2600. PMID: 25983009
- 日本不整脈心電学会. 心臓植込型デバイスにおける遠隔モニタリングステートメント (2016年)
http://new.jhrs.or.jp/guideline/statement201607_01/
改訂版(2018年)
http://new.jhrs.or.jp/guideline/statement201804_01/- Slotwiner D, et al. HRS Expert Consensus Statement on remote interrogation and monitoring for cardiovascular implantable electronic devices. Heart Rhythm. 2015; 12: e69-100. PMID: 25981148
- 日本不整脈心電学会. 新型コロナウイルス感染拡大に伴う植込み型デバイス診療 (医療機関における遠隔モニタリングの導入) (2020年)
http://new.jhrs.or.jp/pdf/others/info20200424.pdf- Lakkireddy DR, et al. Guidance for cardiac electrophysiology during the COVID-19 pandemic from the Heart Rhythm Society COVID-19 Task Force; Electrophysiology Section of the American College of Cardiology; and the Electrocardiography and Arrhythmias Committee of the Council on Clinical Cardiology, American Heart Association. Heart Rhythm. 2020; 17: e233-e241. PMID: 32247013

