心房細動(AF)の有病率は年齢とともに増加し,山形県の検診データ(2017年)によると男性のAF有病率は60~69歳が2.52%,70~79歳が4.88%,80歳以上が7.4%と,高齢者ほど高値であった1)。検診では持続性(慢性)AFの診断が中心であり,高齢者でも頻度が少なくない発作性AFを加えると,80歳以上の男性のAF有病率は10%を超えると予測される。つまり,AFは高齢者のcommon diseaseなのである。
AF例では高齢になるほど脳梗塞,心不全のリスクが高くなり2),機能予後・生命予後が不良となる。最近,健康寿命が注目されているが,健康寿命短縮の大きな要因は脳血管障害と認知症であり,AFに起因する脳梗塞(心原性脳塞栓症)の重症度が高いことを考慮すると3),AFの早期発見と適切な管理治療が健康寿命延伸のために必須となる。
無症候性AFの頻度と問題点
重要なこととして,すべてのAFが動悸などの症状を伴うわけではない(無症候性AF)。とくに発作性AFで無症候であれば,発作時に偶然に心電図が記録されないかぎり,またはペースメーカーなどのデバイスが植込まれていないかぎり,AFは診断されない(潜在性AF)。Fushimi AF Registryの解析結果では4),発作性AFの37%が,持続性AFの67%が,全体としては53%が無症候性であった。さらに無症候性AFの予後(脳卒中/ 塞栓症および総死亡)を有症候性と比較すると,持続性AFでは差がなかったものの,発作性AFでは無症候性が不良であった。これは,持続性AFでは症候の有無に関係なく,検診や外来診療等で診断され,適切な管理治療が実施されやすいのに対し,無症候性の発作性AF(潜在性AF)は診断チャンスに乏しく,管理治療の対象となりにくいためと考えられる。発作性AFの脳梗塞リスクは持続性AFより多少は低いものの(ハザード比=0.63)2),早期発見による早期治療(適応があれば抗凝固療法,カテーテルアブレーションなど)により,予後改善につながるものと思われる。
潜在性AFの検出法
「不整脈の診断とリスク評価に関するガイドライン(2022 年改訂版)」によると5),潜在性AFの検出(診断)法として,①検脈,②血圧計,③ウェアラブルデバイス,④携帯型心電計,⑤ホルター心電図・ループ式レコーダ,⑥植込み型ループレコーダ(ILR),の6つが紹介されている。以下のように簡便なものから精度の高いものの順序で記載され,各々の検出精度(感度・特異度など)が紹介されている。
- ① 検脈: もっとも簡便で,30の研究の統合解析の結果(122,571例),65歳以上のAF非診断例の1.4%にAFが検出された。
- ② 不規則脈波検出機能付き血圧計: 脈不整検出の感度,特異度はともに90%以上と報告されている。
- ③ 着用型スマートデバイス: 最近広く普及しているが,米国アップル社のスマートウォッチを用いたApple Heart Study では,不整脈通知を受けた者の34%でAF が確認され,陽性適中率は84%であった。
- ④ 非ループ式イベントレコーダ(携帯型心電計): 有症候性の不整脈に対する診断はホルター心電図よりも優れているが,無症候性のAFを検出するには,症状に関係なく毎日一定の頻度で記録を繰り返す必要がある。
- ⑤ ホルター心電図・ループ式レコーダ: 日常臨床で広く使用されているが,とくに発作性AF 検出に関しては,長時間記録する必要がある。わが国のREAL-AF 試験(868例)では,14 日間の体外式ループ式イベントレコーダが24 時間ホルター心電図よりもAF 検出率が高く,1 年で3.7% のAF が新規に診断された。脳梗塞リスク[CHA2DS2-VAScスコアが2点(男性)または3点(女性)以上]を有するもののAFは検出されていない1,003例(平均74歳)対象とし,人工知能(AI)アルゴリズムガイドスクリーニング法を前向きに検証した米国のBEAGLE試験の結果が最近報告されている6)。平均22.3日の連続心電図記録(最長30日)により,AIアルゴリズムで低リスクと評価された例(平均72歳)に比して高リスク例(平均75歳)ではより高頻度でAFが検出された(各々1.6%,7.6%;オッズ比=4.98,p=0.0002)。さらに高リスク例では通常の検出法に比して,高頻度でAFが検出された(各々10.6%,3.6%,p < 0.0001)。
- ⑥ 植込み型ループレコーダ(ILR): 最長3年間心電図を記録し,遠隔モニタリングでAF診断が可能な植込み型デバイスである。AF検出の精度はもっとも高いが,わが国における適応は,「原因不明の失神」と「潜因性脳梗塞例におけるAFの診断」のみで,広く適用することはできない。
以上より,AF発症リスクが高い高齢者では,検脈や血圧計による脈不整の検出を連日実施し,AFが疑われれば長時間心電図記録(72時間以上)で確定診断を図ることで,潜在性AF診断率が向上すると思われる。このためにも日本脳卒中協会・日本不整脈心電学会提唱の心房細動週間(図1)や市民健康講座,ネット広告等の啓蒙活動により,一般の国民にAFの問題点を広く周知し,健康寿命延伸のためのAF早期発見の意義を認識してもらい,検脈等を個人レベルで実践する必要があるだろう。
なお,ウェアラブルデバイスは有用と思われるが,所持者に限られ,またその活用法に関しても今後検討する必要がある。

(http://www.shinbousaidou-week.org/より許可を得て掲載)
潜因性脳梗塞と塞栓源不明脳塞栓症(ESUS)
脳梗塞は,①アテローム血栓性脳梗塞,②ラクナ梗塞,③心原性脳塞栓症,④その他の原因(凝固異常,血管攣縮,動脈解離など)による脳梗塞,⑤原因不明の脳梗塞(潜因性脳梗塞)に分類される(SSS-TOAST分類)7)。「潜因性脳梗塞」には,「2つ以上の原因が特定されるが,もっとも確かな原因が不明なもの」,「十分な検査にもかかわらず原因が見つからないもの」,「検査が不十分であったもの」が含まれ,「十分な検査にもかかわらず原因が見つからないもの」が真の潜因性脳梗塞を指す。あくまでも除外診断であるため,診断技術の進歩や施設ごとの検査・診断能力に影響を受けやすい。潜因性脳梗塞の頻度は16~39%と報告され,頻度とともに施設間較差が大きいことも問題であろう8)。
潜因性脳梗塞再発予防のための治療法は確立されておらず,抗血小板薬が選択されることが多い。これに対し,潜因性脳梗塞の多くを占めると想定される塞栓性梗塞については,塞栓源不明脳塞栓症(Embolic stroke of undetermined source:ESUS)という診断名が提唱された8)。再発予防法が確立されていない潜因性脳梗塞の中で,抗凝固薬が有効かもしれない患者集団(AFがあればDOAC投与)を抽出しようとする意図に基づいている。
ESUSの診断基準は,①ラクナ梗塞でない,②梗塞巣に関連する頸部または脳動脈の近位に閉塞ないし50%以上の病変がない,③高リスク塞栓源心疾患(AFや心内血栓など)がない,④特殊な脳梗塞の原因(血管炎,動脈解離,片頭痛,血管攣縮,薬剤不正使用など)がない,の4項目で,塞栓症以外の病態と明らかな塞栓源や血管病変が除外された場合に診断される8)。
ESUS診断のための検査法として,CTまたはMRI,12誘導心電図,経胸壁心エコー,24時間以上の心電図モニター,そして頸部および脳動脈の画像診断が推奨されている。
ESUSの塞栓源としてのAF診断
「不整脈の診断とリスク評価に関するガイドライン(2022 年改訂版)」では5),以下がクラスⅠまたはⅡとして推奨されている。
- ① 脳塞栓の原因として心原性が疑われる場合に経胸壁心エコー検査を行う(クラスI,レベルA)
- ② 脳塞栓の原因として AF が疑われる場合にホルター心電図およびイベント心電図を用いて長時間心電図モニタリングを行う(クラスI,レベルB)
- ③ 潜因性脳梗塞の原因として AF が疑われ,長時間心電図モニタリングで検出されない場合に植込み型ループレコーダ(ILR)植込み術を行う(クラスI,レベルB)
- ④ 脳塞栓の原因として AF が疑われる場合に経食道心エコー検査を考慮する(クラスIIa)
- ⑤ 脳塞栓の原因検索として頸部血管エコー,下肢静脈エコー,大動脈 CT を考慮する(クラスIIa)
- ⑥スマートフォンやスマートウォッチなどを用いた発作性 AF の検出を考慮してもよい(クラスIIb)
潜在性AFの検出には長時間の心電図モニターが必要となるが,ILRにより簡便かつより高感度でAF検出が可能となる。現在わが国では,潜因性脳梗塞(ESUS)症例に対し,長期間(3年間)の心電図記録(遠隔モニター)が可能なILRが保険適応となっている9)。
潜因性脳梗塞例を対象とし,ILRの有効性を前向きに比較検証したCRYSTAL AF試験結果では10),通常の心電図検査のコントロール群(220例,平均61歳)に比し,ILR装着群(221例,62歳)では30秒以上持続するAF検出率が有意に高かった[6カ月の時点でILR群8.9%,コントロール群1.4%(図2上段);12カ月の時点でILR群12.4%,コントロール群2.0%(図2下段)]。
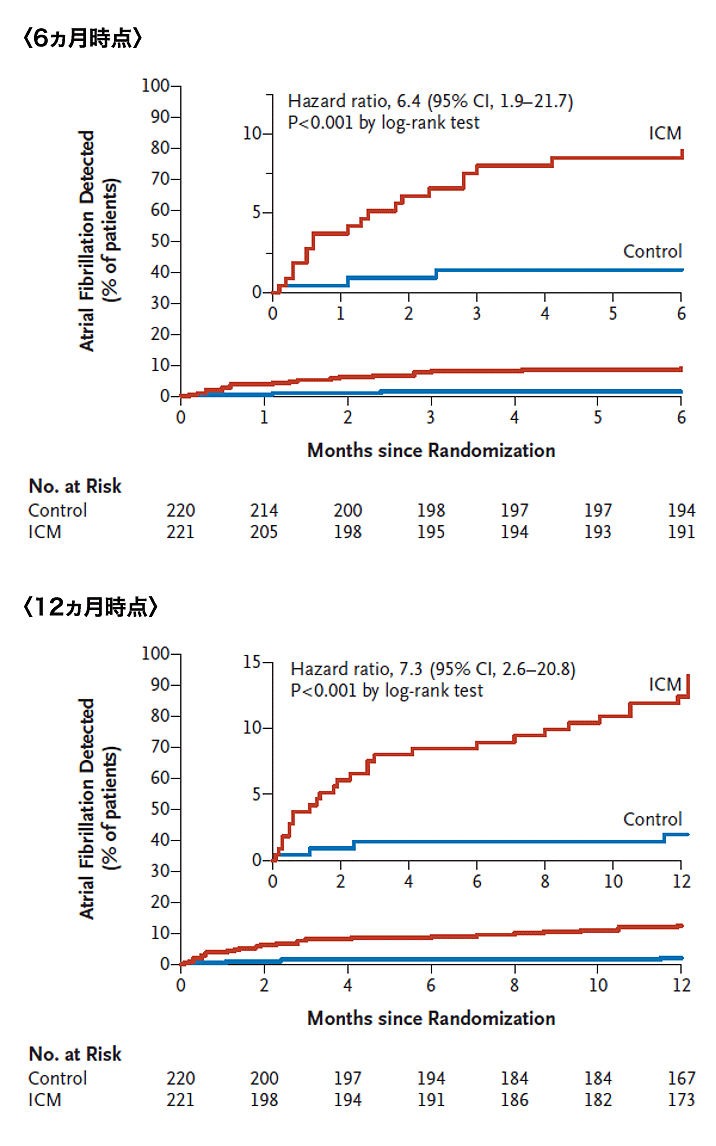
(文献10より引用)
以上の結果はCHADS2スコアを含む患者背景の影響を認めず一貫していた。潜在性AF検出におけるILRの有用性が明らかとなったが,心原性脳塞栓症が再発しやすいことを考慮すると,治療法の確立のためにもILRの積極的な活用が重要と考えられる。
参考文献
- 齋藤良範,他.健診からみた心房細動有病率と治療の状況.人間ドック 2020; 35: 47-53.
- Okumura K, et al. Risk Factors Associated With Ischemic Stroke in Japanese Patients With Nonvalvular Atrial Fibrillation. JAMA Network Open 2020; 3(4): e202881. PMID: 32293685
- 奥村謙,他.心原性脳梗塞の疫学と重症度.心電図 2011; 31: 292-296.
- Esato M, et al. Clinical impact of asymptomatic presentation status in patients with paroxysmal and sustained atrial fibrillation: The Fushimi AF Registry. CHEST 2017; 152: 1266-1275. PMID: 28823813
- 不整脈の診断とリスク評価に関するガイドライン(2022 年改訂版).
https://www.j-circ.or.jp/cms/wp-content/uploads/2022/03/JCS2022_Takase.pdf- Noseworthy PA, et al. Artificial intelligence-guided screening for atrial fibrillation using electrocardiogram during sinus rhythm: a prospective non-randomised interventional trial. Lancet 2022; 400: 1206–1212. PMID: 36179758
- Ay H, et al: An evidence-based causative classification system for acute ischemic stroke. Ann Neurol 2005; 58: 688–697. PMID: 16240340
- Hart RG, et al: Embolic strokes of undetermined source: the case for a new clinical construct. Lancet Neurol 13; 429–438: 2014. PMID: 24646875
- 小笠原邦昭,他.植込み型心電図記録計の適応となり得る潜因性脳梗塞患者の診断の手引き.脳卒中2016; 38: 277-286.
- Sanna T, et al. Cryptogenic stroke and underlying atrial fibrillation. N Engl J Med 2014; 370: 2478-2486. PMID: 24963567

